Оборудование: ПК, экран, проектор, презентация, раздаточный материал.
Электролиз —
совокупность окислительно-восстановительных
процессов, протекающих на электродах
при прохождении электрического тока
через расплав или раствор электролита.
Анодом при
электролизе называется положительный
электрод, катодом —
отрицательный. Положительные ионы — катионы —
(ионы металлов, водородные ионы,
ионы аммония и
др.) — движутся к катоду,
отрицательные ионы — анионы —
(ионы кислотных остатков и гидроксильной
группы) — движутся к аноду.
На
катоде, происходит процесс восстановления
(принятие электронов). На аноде идет
процесс окисления (отдача электронов).
Что такое электролиз
Чтобы понять, что такое электролиз, нужно представить систему, состоящую из электродов с противоположной полярностью, погруженных в жидкий электролит. Электролиз – система процессов, работающих при взаимодействии элементов системы в присутствии постоянного электрического тока из стороннего источника и приводящих к возникновению ионного тока.
В упрощенном виде схема электролиза выглядит так.
Положительный электрод (анод) и отрицательный (катод) притягивают к себе находящиеся в жидкой среде электроны с противоположной полярностью.
Частицы с отрицательным зарядом (их принято называть анионами) движутся к аноду, катионы, несущие положительный потенциал, – к катоду.
Чаще всего в роли катионов выступают водород и ионы металлов, а в роли анионов – хлор или кислород.


Сложно переоценить практическое значение электролиза – комплексного механизма физико-химических процессов. Его механизм достаточно прост, но позволяет эффективно применять электролиз в разных сферах хозяйственной деятельности – от металлургической промышленности до декоративно-прикладной, его можно применять даже в домашних условиях. Электролиз изучает физика и химия, в каждой области наук разработаны специфические технологии, в основе которых лежит один и тот же принцип.
Электролиз (греч. elektron – янтарь + lysis — разложение) – химическая реакция, происходящая при прохождении постоянного тока через
электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно
заряженных ионов (анионов) к аноду (заряжен положительно).

Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания
по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы – положительно заряженные ионы: Na+, K+, Cu2+, Fe3+,
Ag+ и т.д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом
ряду напряжений металлов.

Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней
активности (Cr, Fe, Cd) – на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы
до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды – выделяется водород.
В случае, если на катод поступают ионы водорода – H+ (например при электролизе кислот HCl, H2SO4) восстанавливается
водород из молекул кислоты: 2H+ – 2e = H2
Анод
К аноду притягиваются анионы – отрицательно заряженные ионы: SO42-, PO43-, Cl-, Br-,
I-, F-, S2-, CH3COO-.

При электролизе кислородсодержащих анионов: SO42-, PO43- – на аноде окисляются не анионы, а молекулы
воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор – если он
попадает анод, то разряжается молекула воды и выделяется кислород. Фтор – самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO)
превращается в углекислый газ – CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом
активности металлов.

Теперь вы точно будете знать, что выделяется на катоде 😉
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3,
NaF, FeI2, CH3COOLi.

Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде,
то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
Натрий – активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген – хлор. Мы пишем уравнение, так
что не можем заставить натрий испариться бесследно 🙂 Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO4:
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется
кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача – получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать
методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются
молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.

В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Общая характеристика электрохимических процессов
Реализуемая
мощность источника тока IЕI
оказывается
меньше его теоретической максимальной
мощности IЕI=0;
расходуемая
при проведении электролиза мощность
IЕI
больше
теоретически необходимой IEI=0.
Таким образом, КПД при работе
электрохимических систем меньше 100 %.
Абсолютная
разность ЕI
– EI=0
складывается:
–
из омического падения напряжения внутри
электрохимической ячейки (между катодом
и анодом) Еом
=IRцепи
(Rцепи
– внутреннее сопротивление цепи);
–
из поляризаций катода ΔЕК
и анода ΔЕА.
Любой
электродный процесс всегда имеет ряд
последовательных стадий: сначала
реагирующее вещество подходит к
электроду, затем произойдет собственно
электрохимическая стадия, связанная с
переносом электронов или ионов через
границу раздела фаз (стадия разряда –
ионизации), и, наконец, образовавшиеся
продукты реакции должны отойти от
поверхности электрода, чтобы освободить
место для новой порции реагирующего
вещества.
Механизмы
образования растворов электролитов
Термин
«электролитическая диссоциация»
подразумевает образование ионов в
растворе при распаде нейтральных молекул
растворяемого вещества.
Однако
часто ионы существуют уже до растворения.
Так, например, твердый хлорид натрия
представляет собой кристалл, построенный
из ионов Nа+
и Сl-.
В
ряде случаев раствор электролита
действительно получается при растворении
вещества, состоящего из нейтральных
молекул. Так, например, при растворении
в воде газообразного хлористого водорода
получается раствор сильного электролита
– соляной кислоты.
Электрохимические
цепи обычно классифицируют по двум
признакам:
1)
по источнику электрической энергии;
2)
по наличию или отсутствию в цепи границы
двух различных растворов: соответственно
цепи с переносом и без переноса.
В
физических цепях источником электрической
энергии служит различие в физическом
состоянии двух одинаковых по своему
химическому составу электродов.
Аллотропические
цепи
–
это цепи в которых менее устойчивое
состояние одного электрода обусловлено
тем, что он изготовлен из метастабильной
модификации данного металла.
Гравитационная
цепь
состоит из двух ртутных электродов в
растворе. В результате этих двух
электродных процессов происходит
перенос металлической ртути из левой
части в правую, который направлен на
выравнивание их уровней.
В
концентрационных
цепях
оба электрода идентичны как по физическому
состоянию, так и по химической природе
участников окислительно-восстановительных
процессов.
Различают
концентрационные цепи без переноса, т.
е. без границы двух растворов, и с
переносом, когда имеется такая граница.
Биологические
мембраны и биоэлектрохимия
В
основе транспорта веществ через мембраны
лежат электрохимические закономерности.
Этот пример указывает на важность
электрохимического подхода к исследованию
биологических объектов.
Полупроницаемые
мембраны и, следовательно, мембранные
явления чрезвычайно распространены в
живой природе. Так, клеточные или
плазменные мембраны отделяют внутреннюю
часть любой живой клетки от окружающей
среды. Составы растворов внутри и снаружи
клеток различны, а сами мембраны обладают
избирательной проницаемостью.
Особенность
электролиза – пространственное разделение
процессов окисления и восстановления:
электрохимическое окисление происходит
на аноде, восстановление – на катоде.
Электролиз осуществляется в специальных
аппаратах – электролизёрах.
Электрохимическая
реакция получения того или иного вещества
(в атомарном, молекулярном или ионном
состоянии) связана с переносом от
электрода в электролит (или обратно)
одного или нескольких зарядов в
соответствии с уравнением химической
реакции.
Скорости
электродных реакций зависят от состава
и концентрации электролита, от материала
электрода, электродного потенциала,
температуры и ряда других факторов.
Скорость каждой электродной реакции
определяется скоростью переноса
электрических зарядов через единицу
поверхности электрода в единицу времени;
мерой скорости, следовательно, служит
плотность тока.
Преимущества
электролиза перед химическими методами
получения целевых продуктов заключаются
в возможности сравнительно просто
(регулируя ток) управлять скоростью и
селективной направленностью реакций.
Электролиз
– основной метод промышленного производства
алюминия, хлора и едкого натра, важнейший
способ получения фтора, щелочных и
щелочноземельных металлов, эффективный
метод рафинирования металлов. Путём
электролиза воды производят водород и
кислород.
Электролиз водных растворов
На
процессе электролиза в водных растворах
влияние оказывают продукты диссоциации
воды
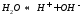
Поведение
катионов металлов при электролизе
зависит от расположения металла в ряду
активности, возможны 3 случая:
а)
катионы металлов (от Li+
по Al3+)
не восстанавливаются на катоде, а вместо
них восстанавливаются молекулы воды;
б)
катионы металлов (от Sn2+
по Au+)
полностью восстанавливаются на катоде;
в)
катионы металлы средней части ряда от
(Al3+
до Sn2+)
восстанавливаются на катоде одновременно
с молекулами воды.
Вода
на катоде (-)
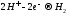
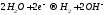
Аноды
могут быть растворимые (активные) и
нерастворимые (инертные).
Активные
аноды
изготавливают металлов (из меди, серебра,
железа), они сами растворяются, т.е.
окисляются при электролизе.
Инертные
аноды из
угля, графита, платины, они не окисляются,
т.е. не растворяются при электролизе, а
служат для передачи электродов во
внешнюю цепь. На инертном аноде происходит
окисление анионов раствора или молекул
воды. При этом анионы бес кислородных
кислот легко окисляются, а вместо
кислородосодержащих анионов окисляется
вода.
Вода
на аноде (+)
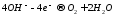
Б)
нейтральная и кислая среда
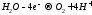
Различают электролиз или химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений:

Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал, тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H+.
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
Если металл в соли — (до Al3+ включительно в ряду напряжений), то вместо металла на катоде восстанавливается (разряжается) , т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH—, среда возле катода — щелочная:
, при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
Если металл в соли – средней активности (между Al3+ и Н+), то на катоде восстанавливается (разряжается) и , и , так как потенциал таких металлов сравним с потенциалом водорода:
, при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов), то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только
при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Если на катод попадают катионы водорода H+, то они и восстанавливаются до молекулярного водорода:
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H-2).
При электролизе растворов солей наблюдаются следующие закономерности:
Если на анод попадает бескислородный кислотный остаток, то он окисляется до свободного состояния (до степени окисления 0):
: при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2ē = 0
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно . Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы:
Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион, то окислению подвергается вода с выделением молекулярно-го кислорода:
Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
, при электролизе растворов выделяется углекислый газ и этан:
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
, электролиз раствора сульфата меди. восстанавливаются ионы меди:
окисляются молекулы воды:
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
Электролиз раствора выглядит так:
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора :
Следующий : электролиз водного раствора
восстанавливается водород из воды:
окисляются молекулы воды до молекулярного кислорода:
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
Еще один : электролиз водного раствора хлорида меди (II).
окисляются хлорид-ионы до молекулярного хлора:
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Еще несколько примеров: электролиз раствора гидроксида натрия.
окисляются гидроксид-ионы до молекулярного кислорода:
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
Законы электролиза
Количественная
характеристика процессов электролиза
определяется законами Фарадея.
Масса
вещества, выделившегося на электроде,
прямо пропорциональна электрическому
заряду, прошедшему через электролит.
При
постоянном количестве прошедшего
электричества массы образующихся на
электродах веществ пропорциональны их
эквивалентным массам:
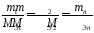
Для
выделения 1 эквивалента вещества нужно
пропустить через электролизер 1 Фарадей
количества электричества:
В
обобщенном виде законы Фарадея записывают:
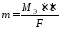
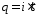
где
m
– масса в-ва образуемого на электроде
(в г); Мэ
– эквивалентная масса; i
– сила тока (в А);
τ
– время электролиза; q
– количество электричества
Электрохимический
эквивалент КЭ
– число, показывающее какая масса
вещества выделится на электродах при
прохождении 1 Кл электричества
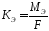
Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присутствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
, рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
разряжаются ионы меди из раствора:
На аноде окисляются частицы меди из электрода:
Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 20 ЕГЭ по химии) ( с ответами)

Тренажер задания 20 ЕГЭ по химии
Установите соответствие между формулой вещества и продуктами электролиза водного раствора этого вещества на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Установите соответствие между солью и продуктами электролиза водного раствора этой соли, которые выделились ка инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Установите соответствие между веществом и возможным способом его получения путём электролиза: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Установите соответствие между названием простого вещества и способом его электролитического получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Установите соответствие между формулой вещества и продуктами электролиза его водного раствора, которые образуются на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Установите соответствие между формулой вещества и продуктами электролиза его водного раствора на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Установите соответствие между формулой соли и уравнением процесса, протекающего на аноде при электролизе её водного раствора.
Установите соответствие между формулой вещества и продуктами
электролиза водного раствора этого вещества, образовавшимися на инертных К каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Установите соответствие между формулой соли и продуктами, образующимися на инертных электродах при электролизе его водного раствора.
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
электролиз расплава хлорида натрия. восстанавливаются катионы натрия:
окисляются анионы хлора:
Суммарное уравнение электролиза расплава хлорида натрия:

электролиз расплава гидроксида натрия. восстанавливаются катионы натрия:
Суммарное уравнение электролиза расплава гидроксида натрия:
Многие металлы получают в промышленности электролизом расплавов.
В растворе криолите оксид алюминия диссоциирует на ионы:
Al2O3 = Al3+ + AlO33-
восстанавливаются катионы алюминия:
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
223 = 4 + 32

В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
Электролиз в средах
Различие принципов прохождения электролиза расплавов и растворов – это то, что в растворе, кроме частиц вещества, присутствуют молекулы воды, которые препятствуют восстановлению на катоде некоторых веществ.
Вода
Включаясь в реакцию электролиза, вода H2O конкурирует с ионами электролита и анода за восстановление на катоде.
В зависимости от свойств вещества в процессе электролиза водного раствора на отрицательном электроде могут восстановится кислород, катионы из жидкой среды или молекулы растворимого анода.
Например, в случае NaF электролиза процесс проходит только для ионов воды, разделяющихся на кислород и водород.
Расплавы солей
Из-за отсутствия «конкуренции» молекул воды электролиз расплавов предсказывается и просчитывается проще, чем реакция раствора.
Все металлы, вне зависимости от активности, реагируют одинаково.


ГИДРОКСИД НАТРИЯ, ВОДОРОД И ХЛОР ПОЛУЧАЮТ ЭЛЕКТРОЛИЗОМ ВОДНОГО РАСТВОРА NaCI

Растворы солей
Рассчитать результат реакции электролиза раствора сложнее, даже если не учитывать наличие возможных примесей. Ведь, кроме молекул солей металлов, при протекании электролита на процесс влияют молекулы воды, имеющие значимое влияние на ход процесса.
В течение электролиза растворов солей на отрицательном электроде будут восстанавливаться либо водород, либо катионы электролита, либо молекулы металла.
Результат зависит от того, сколько внешней энергии понадобится в каждом случае – в приоритете будет реакция с наименьшим потреблением электричества.
Электролиз растворов приведет к тому, что к катоду устремятся ионы с максимальным энергетическим потенциалом, а анод привлечет анионы, обладающие самым маленьким потенциалом.
В примере с электролизом раствора хлорида натрия на катоде можно получить лишь водород.
Электролиз раствора соли карбоновых кислот способствует окислению атома углерода и происходит выделение углекислого газа
Раствор сульфата меди на аноде молекулы воды
Особенности электролиза в растворах
Результат водных реакций электролиза в присутствии воды зависит только от позиции металла в электрохимическом ряду напряжений. Правила электрохимического процесса растворов на катоде таковы:
- На отрицательном электроде появляется вода и выделяется кислород, если металл, содержащийся в электролите, располагается левее алюминия (входит в перечень от лития до алюминия), например, при электролизе раствора хлорида натрия.
- Совместное восстановление воды и ионов металла происходит в случае нахождения металла в ряду от алюминия до водорода (от магния до свинца включительно).
- Восстановление только металла на катоде возможно, если вещество электролита располагается правее водорода (ряд от меди до золота включительно). Электролиз раствора на аноде зависит от состава электрода. Активный анод в любом случае окисляется, а иногда и полностью растворяется сам. Инертный электрод, состоящий из графита, платины или золота, проявляет такие свойства:
- В присутствии солей бескислородных кислот, исключая фториды, анод будет окисляться.
- Электролиз оксикислот (таких, как раствор азотной кислоты HNO3) и соединений фтора ведет к окислению воды, ионы металла останутся в жидкости.
- Прохождение электричества через раствор щелочей выделит из электролита гидроксид-ионы. Чтобы добиться реакции от некоторых кислот, например, провести электролиз уксусной кислоты, необходимо сделать достаточно разбавленный водный раствор, чтобы она стала проявлять признаки электропроводности.
Растворы электролитов с инертными электродами
Чтобы лучше понять процессы, проходящие с участием инертных электродов, стоит рассмотреть несколько наглядных примеров:
- Гидроксид натрия (NaOH). Позиция натрия находится левее алюминия, следовательно, его катоды на будут восстанавливаться из электролита. При катодном электролизе раствора гидроксида натрия восстановится водород, гидроксиды 2OH на аноде окисляются до кислорода и воды.
- Сульфат меди CuSO4. Место меди находится в ряду напряжений правее, чем водород, поэтому полностью восстановится на катоде. Анод окислит молекулы воды, а кислотные остатки кислородом останутся в электролите.
- Серная кислота H2SO4. На катоде будут восстановлены только катионы водорода, на аноде будет идти процесс окисления воды.
- Сульфат натрия Na2SO4. Как и в предыдущем примере, катионы натрия останутся в электролите, на катоде восстановится водород. Анион сульфат ион, как кислородсодержащих, так же не смогут выделиться из жидкости.
В газах
Газ сможет выступить в роли электролита лишь в присутствии ионизатора.
Электроэнергия сможет произвести ожидаемую реакцию на электродах, только пройдя через ионизированную среду.
В этом случае законы Фарадея не имеют силы. Процесс газового электролиза подчиняется таким правилам:
- Воздействию доступны только кислоты, находящиеся в газообразном состоянии и не содержащие кислорода, или некоторые газы.
- Реакция не осуществится без искусственной ионизации среды, вне зависимости от силы или напряжения электроэнергии.
Если происходит распад электролита на ионы то это электролитическая диссоциация.
Ход урока
Приветствие учащихся. Проверка готовности к уроку.
Проверка домашнего задания
- На какие три группы делятся вещества по типу проводимости?
- Что такое проводники первого рода?
- Что является носителем заряда в проводниках первого рода?
- Что такое электролит?
Определение понятия электролит и пример электролита
Убедимся для начала, что жидкость (в нашем случае электролит – раствор медного купороса) может пропускать электрический ток. Для этого проведем демонстрационный опыт.
Демонстрационный опыт с реакцией электролиза
Цель опыта: убедиться, что жидкость, в частности раствор медного купороса, может пропускать электрический ток.
Оборудование: источник тока, ключ, лампа, раствор медного купороса, налитый в ванночку, медная пластинка, железный гвоздь, соединительные провода с “крокодилами”.Теоретические сведения
Процесс протекания тока через раствор электролита и образование веществ на электродах называется электролизом.
Электролиз – это химическая реакция, которая может протекать только под действием электрического тока
Вещества с ионной химической связью в растворе распадаются на ионы, которые и будут являться носителями заряда в электролите.
Так как электролиз – это химическая реакция, то ее протекание должно сопровождаться превращением одних веществ в другие. Эти превращения происходят вблизи электродов, погруженных в раствор электролита, или на самом электроде. Положительно заряженный электрод называется анодом, отрицательно заряженный – катодом
1. Собирается цепь, состоящая из источника тока, ключа, лампы, ванночки с электролитом, соединенных последовательно, как показано на рисунке.
Цепь для демонстрации реакции электролиза
2. Ключ замыкают на несколько секунд.
3. Ключ размыкают и достают электроды из ванночки.
Катод, покрытый красноватой пленкой
Эта пленка – чистая медь, образовавшаяся в ходе реакции электролиза. При прохождении электрического тока через раствор медного купороса, протекает окислительно-восстановительная реакция, в результате которой на катоде образуется слой меди.
Эта медь не перешла на катод с анода – она образовалась вследствие восстановления на катоде ионов меди, которые образуются в растворе медного купороса вследствие электролитической диссоциации вещества, содержащего в себе ионную связь.
Важно отметить, что этот опыт лишь демонстрирует протекание реакции электролиза, но не дает ни одной количественной характеристики этой реакции. Количественные характеристики этой реакции дает закон Фарадея, вывод которого приведен на рисунке.
Вывод закона Фарадея для электролиза
Сегодня электролиз имеет важное значение. Он применяется во многих областях промышленности.
Области применение электролиза
- При нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
- В очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации)
- Для промышленного получения алюминия, меди, водорода, диоксида марганца. Большое количество металлов извлекается из руд и подвергается переработке с помощью электролиза (электроэкстракция, электрорафинирование)
- Электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Решение задач
Для закрепления материала необходимо решить задачу на закон электролиза.
Задача: Последовательно с электролитической ванной, заполненной солью никеля, включена ванна, в которой находится соль хрома. После размыкания цепи в первой ванне выделилось 10 г никеля. Сколько хрома выделилось во второй ванне?
Решение: Сила тока, протекающего по обеим ваннам, одинакова, тогда по закону Фарадея.mNi/kNi = mCr/kCrmCr = kCr/K*mNi
Вычисления: mCr = (0,18 мг/Кл : 0,3 мг/Кл) x 10 г = 6 г.
Ответ: mCr = 6 г.
Закрепление изученного
– Что такое электролит?- Что является носителем тока в электролитах?
– Что такое реакция электролиза?- Чему пропорциональна масса вещества, выделившегося на катоде в реакции электролиза?
§ 3.4 – 3.66 стр. 264 – 273.
Факторы, влияющие на электролиз
Формулы описывают прохождение реакции в идеальной среде, без учета множества сопутствующих факторов, способных изменить ожидаемый результат. Кроме учтенного в законах комплекса составляющих, на суммарное составляющие реакции влияют:
- Состав электролита. На ход реакции и ее результат влияют посторонние примеси, попавшие в электролит. Их разделяют на катионные, анионные и органические. Посторонние молекулы имеют более или менее отрицательный потенциал, чем основное соединение, а это сильно мешает процессу. У концентрации органических загрязнений (это могут быть ПАВ или масла) есть конечное допустимое значение.
- Плотность электричества. Законы Фарадея утверждают, что, чем мощнее сила тока, тем больше количество вещества, которое осядет на электродах. На практике увеличение силы тока часто становится причиной неблагоприятных явлений – интенсивный нагрев электролита, концентрированная поляризация электродов, чрезмерное напряжение тока. Чтобы получить ожидаемый от электролиза результат, следует соблюдать оптимальные для каждой ситуации значения плотности энергии.
- Температура электролита. Ее действие неоднозначно. С одной стороны, с ее увеличением растет интенсивность реакции, с другой – повышается активность посторонних примесей. Поэтому необходимо следить, чтобы температура жидкости находилась в оптимальных пределах для конкретного случая, обычно это 38-45 градусов.
- Кислотно-щелочной баланс электролита. Оптимальное значение pH среды зависит от определенного вещества. Возможно контролировать скорость протекания электролиза и его результат, доводя его до оптимального, если верно сочетать влияние имеющихся факторов. Для каждого вида реакции опытным путем выработаны нужные режимы работы, которых необходимо придерживаться.

Усовершенствована технология прямого электролиза морской воды
21 мая 2022
Морская вода является одним из самых богатых ресурсов на Земле. Прямой электролиз морской воды — интригующая технология устойчивого производства водорода, которая не усугубит глобальную нехватку пресной воды или не увеличит выбросы углерода. Однако эта технология серьезно затруднена отсутствием надежных и активных электрокатализаторов.
То есть из-за нежелательной анодной реакции выделения хлора и сильной коррозионной активности морской воды этой технологии значительно препятствует отсутствие надежных электрокатализаторов реакции выделения кислорода, которые проявляют высокую активность, высокую селективность и хорошую стабильность.
Ученые в своей новой работе продемонстрировали гомогенный мультиметаллический катализатор, состоящий из никеля и железа, коинкорпорированных в слоистый двойной гидроксид CuCo (далее — LDH), который служит активным и прочным электродом для эффективного электролиза морской воды. Далее ученые провели ряд экспериментов с обильными открытыми мультиметаллическими участками и четко определенными микронаноструктурами.
В экспериментах катализатор LDH требует перенапряжений только 259, 278 и 283 мВ для получения плотностей тока 100, 300 и 500 мА −2, соответственно, в 6 М электролите морской воды KOH. Было обнаружен, что катализатор LDH также проявляет очень высокую селективность электрода с фарадеевской эффективностью 97,4% для O2 при 500 мА см−2 и превосходную долговечность во время работы, стабильно работая при большой плотности тока 500 мА см−2 до 500 ч в электролите морской воды 6 М КОН. Данные были получены при использовании различного оборудования для анализа воды.
Этот мультиметаллический электрокатализатор является одним из наиболее эффективных среди всех известных электрокатализаторов на основе переходных металлов в щелочном электролите морской воды, что способствует развитию технологии электролиза морской воды.
Таким образом, ученые продемонстрировали высокоэффективной электрокатализатор, состоящей из мультиметаллических слоистых двойных гидроксидов, который обеспечивает превосходные каталитические характеристики и долгосрочную долговечность для эффективного электролиза морской воды. Насколько известно, этот катализатор является одним из наиболее активных для осуществления успешной реакции выделения кислорода. Он станет отличной основой для развития технологии электролиза морской воды.

Электролиз в промышленности
Принцип разделения веществ с помощью электричества не сложен и хорошо изучен, поэтому много где применяется. В результате разложения получаются различные химических вещества (металлы, щелочи, газы) в чистом виде, производится синтез органических частиц и неорганического материала, очистка сточных вод, разряжаются аккумуляторы, защищаются от коррозии и других негативных воздействий поверхности техники, инструментов и предметов быта.
Электролиз – это основной (а зачастую – и единственный) способ получения вещества высокой чистоты и качества.
Применение электролиза в технике, благодаря способности катода осаждать на себе молекулы химических элементов, позволяет создавать прочные бесшовные трубы, надежное защитное покрытие для металлических поверхностей, ювелирные украшения, точные слепки со сложных форм.
Добыча металлов
Электролиз расплавов эффективно используется при выделении из руды или солей активных металлов вроде алюминия, калия, бериллия или натрия.
Чтобы создать электролит из бокситов – алюминиевой руды, в которой металл находится в виде оксида – их растворяют в криолите.
В емкости, где проходит электролиз, катодом является дно, покрытое слоем углерода, а анодом – инертный углеродный стержень. В результате этой реакции продукт электролиза – чистый алюминий – скапливается на дне и сливается через специальные отверстия.

Электрометаллургия
Добыча металлов в электрометаллургии производится двумя видами процессов – электротермическими и электрохимическими. В первом случае выделение из руд и концентратов чистого вещества или образования сплава достигается за счет использования электричества как источника тепловой энергии. Во втором случае производство металла основывается на принципах электрохимического взаимодействия веществ.
Электролиз расплава или раствора солей дает возможность получать металлы повышенной чистоты, отделяя их от примесей буквально по молекулам.
Процесс рафинирование – это очистка меди
Чтобы получить очень чистую, рафинированную медь, в качестве электродов используются стержни или пластины из уже очищенного и с примесями металла и электролита – раствора сульфата меди.
Загрязненный электрод заряжается положительно и, в качестве активного анода, растворяется в процессе реакции.
Молекулы меди осаждаются на чистом катоде, а примеси выпадают на дно емкости в виде осадка. Таким же способом очищают золото, серебро и другие цветные металлы.
Гальванопластика
С помощью нанесения на исходный предмет равномерного металлического слоя возможно создать неограниченное число его копий. Для этого с оригинала снимается слепок и покрывается слоем электропроводящего вещества. Таким образом делаются слепки со сложных поверхностей, украшения и многого другого.

Гальванополировка
Принцип гальванополировки базируется на том, что, когда исходный предмет в электролите подвергается действию электричества, то самое сильное электрополе возникает на выступах его поверхности.
Если он заряжен положительно, то в процессе электролиза быстрее всего теряет выступающие электроны и таким способом становится более гладким, то есть полируется.
Анодирование
Защитное покрытие поверхности металла в этом случае выполняется за счет неметаллических соединений и серной кислоты.
Металлическая деталь выступает в роли анода, а электролитом служит кислота.
При электролизе на поверхности анода образуется декоративный и защитный слой из оксида металла.
Сфера применения технологии остаточно широка, ее принципы давно использовались даже в домашних условиях. Но очень важно тщательно соблюдать технику безопасности.

Гальваническое покрытие
Электролизом можно нанести тонкий равномерный слой металла на поверхность предметов с целью сделать ее менее активной, защитить от негативных влияний, украсить, повысить или понизить электропроводимость.
При этом обрабатываемый предмет выступает в роли электрода, а соль металла – как электролит.
В зависимости от дальнейшего предназначения гальванизируемого предмета его таким способом покрывают цветными и драгоценными металлами.
Энергетические затраты
Применение электролиза требует высоких затрат энергии по нескольким причинам:
- Чтобы процесс электролиза был эффективным, необходимо обеспечить присутствие постоянного тока на электроды в течение длительного времени;
- Часто полезный результат реакции напрямую зависит от силы тока – чем выше напряжение, тем быстрее и качественнее она проходит.
- Часть энергии теряется вследствие сопротивления электролита, анодного или катодного перенапряжения.
Течение реакции, энергетические затраты и полученную пользу можно спрогнозировать, зная основные законы электролиза.
Электролиз и законы Фарадея
Майкл Фарадей – английский физик-экспериментатор, совершивший несколько важных открытий, касающихся электромагнитных явлений. Электрохимические исследования природы реакций, опубликованные ученым в 1836 году, позволили ему сформулировать законы электролиза. Они формулируют связь между количеством вещества, полученного в процессе электрохимической реакции, и объемом электроэнергии, повлиявшей на электролит.
Первый закон
В общем виде первое правило электролиза Фарадея звучит так: масса вещества, присоединившаяся к электроду при реакции прямо пропорциональна объему электричества, прошедшего через электролит с помощью электродов. Формула реакции:
m = kq = k*I*t
(значения переменных: q – заряд, k –электрохимический эквивалент (коэффициент) вещества, I – сила тока, влияющего на электролит, t – время прохождения электричества).

Второй закон
Следующее правило электролиза Фарадея формулируется: масса вещества, которую получит электрод при воздействии определенного количества тока, прямо пропорциональна эквивалентной массе этого же вещества.
Этим термином обозначают молярную массу, деленную на целое число, определяющееся реакцией химии, в которой элемент участвует. В другой формулировке закон выглядит так: равное количество электроэнергии ведет к выделению на электродах в течение электролиза эквивалентных масс разных элементов.
Для выделения одного моля вещества нужно затратить определенный объем электроэнергии, равный 96 485 Кл/моль.
Эта константа стала называться числом Фарадея. Самая простая формулировка закона гласит: электрохимический эквивалент каждого элемента прямо пропорционален его молярной массе и обратно пропорционален валентности этого же элемента. Формула:
m = Q/F*A/z
(значения переменных: m – искомая масса полученного вещества, Q – количество полного заряда, прошедшего через электроды, F – число Фарадея, А- молярная масса, z – химическая валентность элемента). Соединяя вместе все значения, описанные в обоих законах, можно вывести общую формулу, определяющую массу собранного на электродах вещества: m = A*I*t/(n*F) (n – заряд иона или количество электронов, участвующих в реакции электролиза).

Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав
Раствор или расплав электролита помещают в специальную емкость — .
— это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают .
— это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод — притягивает положительно заряженные ионы — . Положительно заряженный электрод () притягивает отрицательно заряженные частицы (). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.

Различают электролиз с и электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, , или .
Электрофорез
Лечебная процедура, использующая принцип электролиза, называется электрофорезом. Препараты вводятся непосредственно в кожу, чтоб они быстрее попали в кровь и подействовали. Для этого между специальными электродами и телом человека прокладывается материал, пропитанный электропроводящим лекарственным веществом. Заряженные частицы под воздействием электричества проникают в кожу и тело пациента.
Скорость проникновения лекарства можно регулировать, варьируя силу тока.
Особенности процессов, происходящих на катоде и аноде
Электроды – стержни, сделанные из материалов с высокой электропроводностью. Их можно разделить на две категории – активные электроды, которые, окисляясь, участвуют в обмене ионами, и инертные – из графита, угля или платины, исполняющие только функцию проводников.
Активные электроды – аноды – могут окислиться до полного растворения в электролите, отдав ионы катоду.
Чтобы правильно рассчитывать формулы и получать ожидаемый результат электролиза – будь то в рамках школьной подготовки к ЕГЭ, экзаменам или в процессе работы предприятия – необходимо понимать, как именно участвуют электроды разной полярности в течении реакции. К электроду, имеющему отрицательный заряд, – катоду – притягиваются ионы с противоположным зарядом «+», например, металлы: натрий (Na+), калий (K+), медь (Cu2+), железо (Fe3+), серебро (Ag+) и прочие.
Процесс электролиза на катоде сильно зависит от того, насколько активно вещество.
Определить фактор поможет его позиция в ряду электрохимической активности металлов:
- Сильно активный металл (литий, натрий, калий), взаимодействуя с катодом, вместо себя восстанавливает молекулы воды, из которых, в свою очередь, выделяется водород.
- Средняя активность металла (хрома, железа, кадмия) способствует образованию на катоде и воды, и молекул вещества.
- Малая активность металла (меди, серебра) позволяет получить молекулы вещества в чистом виде.

Промежуточным звеном в ряду напряжения между высоко- и среднеактивными металлами считается алюминий.
Все металлы, находящиеся в ряду до него включительно, не восстанавливаются на катоде, выделяя только водород из молекул воды.
К положительно заряженному аноду стремятся анионы с «+», а к отрицательно заряженному катоду катионы с «-«.
Они притягивают к себе электроны из проводника, окисляя его, меняют заряд на положительный и притягиваются к катоду.
Анодный процесс иногда приводит к полному растворению электрода из активного вещества в электролите.
Анионы разных элементов также различаются по степени активности. Такой процесс, как окисление, имеет особенности, зависящие от дополнительных составляющих анионов:
- Молекулы, содержащие кислород – сульфаты, фосфорные кислоты – при электролизе окисляют молекулы воды, выделяя из них кислород.
- Бескислородные анионы, взаимодействуя с анодом, выделяют определенные галогены: как примеры, из сульфидов выделяется сера, из хлоридов — хлор. Все неметаллы проще окисляются, чем кислород. Исключение – фтор, который, как самое электроотрицательное вещество, в результате реакции окисляет молекулы воды в растворе до кислорода.
- Органический элемент окисляется на аноде так: присоединенный к карбоксильной группе радикал удваивается, а сама группа принимает форму газа (CO2).
Таблица изменения веществ при электролизе

Выход по току
Показателем
эффективности электролиза является
выход по току – отношение массы фактически
полученного при электролизе полезного
продукта к его массе отвечающей законам
Фарадея:
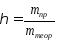
7.Комплексные
соединения. Состав и строение комплексных
соединений: комплексообразователь,
лиганды, комплексный ион, координационное
число, внутренняя и внешняя сфера.
Номенклатура комплексных соединений.
При
взаимодействии молекул часто образуются
более сложные соединения, соединения
высшего порядка.
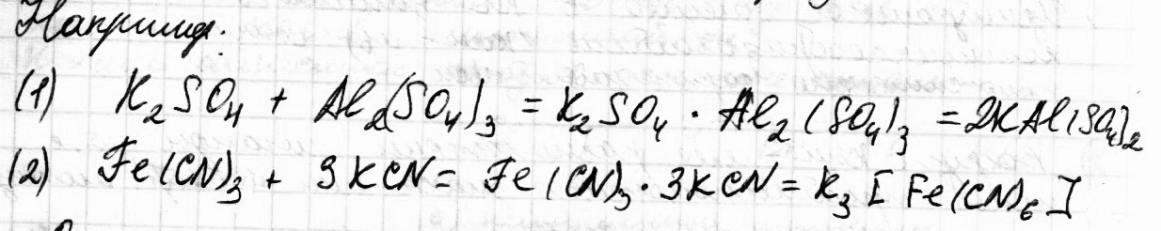
Одни
из них диссоциируют на все составляющие
ионы, и называются двойными
солями (1),
другие на сложные (комплексные ионы), и
называются комплексными
или координационными соединениями (2).
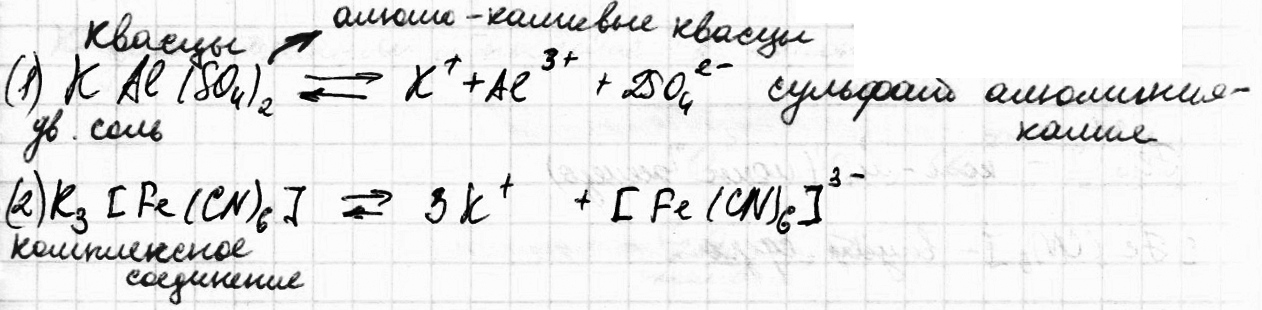
К
комплексным соединениям относятся
такие вещества, которые содержат группу,
способных к независимому существованию
атомов или молекул (лигандов),
координированных в определенном порядке,
вокруг центрального атома, называемого
комплексообразователем.
